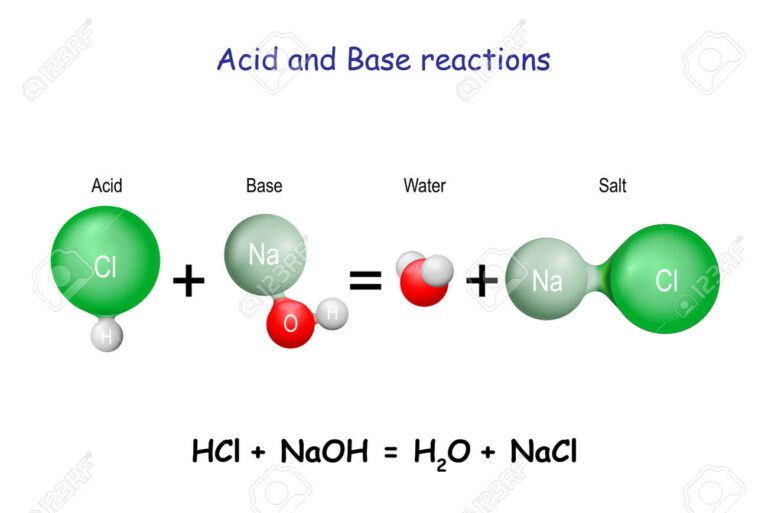
El agua puede comportarse como ácido o como base debido a su capacidad de actuar como un ácido débil o una base débil en determinadas situaciones. Este fenómeno se conoce como la autoionización del agua, donde las moléculas de agua pueden transferir un protón (un ion de hidrógeno) entre sí.
En condiciones normales, el agua se encuentra en equilibrio, con una pequeña cantidad de moléculas de agua que se disocian en iones hidrógeno (H+) y iones hidroxilo (OH–). Si una solución acuosa tiene un exceso de iones hidrogeno, se considera ácida, mientras que si tiene un exceso de iones hidroxilo, se considera básica.
La escala de pH se utiliza para medir el grado de acidez o basicidad de una solución acuosa, donde un pH menor a 7 indica acidez, un pH de 7 indica neutralidad (como el agua pura) y un pH mayor a 7 indica basicidad. Es importante tener en cuenta que el agua pura a 25°C tiene un pH de aproximadamente 7, lo que la sitúa en la categoría de neutral.
Entendiendo los conceptos básicos de ácidos y bases
Para comprender por qué el agua puede comportarse como un ácido y una base, es fundamental tener claros los conceptos básicos de ácidos y bases. En química, los ácidos son sustancias que liberan iones de hidrógeno (H+) en solución, mientras que las bases son sustancias que liberan iones de hidróxido (OH–).
Un ejemplo clásico de ácido es el ácido clorhídrico (HCl), que al disolverse en agua libera iones de hidrógeno, aumentando la concentración de H+ en la solución. Por otro lado, un ejemplo de base es el hidróxido de sodio (NaOH), que al disolverse en agua libera iones de hidróxido, incrementando la concentración de OH– en la solución.
Equilibrio ácido-base del agua
El agua, a pesar de ser una molécula neutra, puede actuar tanto como ácido como base debido a la capacidad de sus moléculas de autodisociarse en iones H3O+ (ácido) y OH– (base). Este fenómeno se conoce como la autodisociación del agua:
| Reacción de autodisociación del agua: |
|---|
| 2H2O(l) ↔ H3O+(aq) + OH–(aq) |
En esta reacción, una molécula de agua se divide en un ion hidronio (H3O+) y un ion hidróxido (OH–), lo que le permite al agua comportarse como tanto ácido como base. Este equilibrio es fundamental para mantener un pH neutro en el agua pura, donde la concentración de iones H3O+ es igual a la concentración de iones OH–.
Comprender la autodisociación del agua y el equilibrio ácido-base es esencial en campos como la química, la biología y la geología, ya que muchos procesos biológicos y ambientales dependen de estos conceptos fundamentales.
El papel del agua en las reacciones ácido-base: concepto de autoprotólisis
El agua desempeña un papel fundamental en las reacciones ácido-base a través de un proceso conocido como autoprotólisis. Este fenómeno es clave para comprender por qué el agua puede comportarse tanto como ácido como base.
La autoprotólisis del agua es una reacción química en la cual dos moléculas de agua reaccionan entre sí para formar un ion hidronio (H3O+) y un ion hidróxido (OH–). Esta reacción se representa de la siguiente manera:
2H2O(l) ↔ H3O+(aq) + OH–(aq)
Este equilibrio es fundamental para entender el comportamiento ácido-base del agua y de otras sustancias en disolución acuosa. La constante de equilibrio para esta reacción se conoce como la constante de autoprotólisis del agua, Kw, que tiene un valor de 1 x 10-14 a 25 ºC.
La autoprotólisis del agua es la base de la escala de pH, que mide la acidez o basicidad de una solución. Un pH menor a 7 indica que la solución es ácida, mientras que un pH mayor a 7 indica que la solución es básica. Un pH de 7 corresponde a una solución neutra, donde la concentración de iones hidronio es igual a la concentración de iones hidróxido.
Esta capacidad del agua para comportarse como ácido o base es fundamental en numerosos procesos químicos y biológicos. Por ejemplo, en la digestión, el agua actúa como medio para que las enzimas presentes en el tracto digestivo puedan llevar a cabo reacciones ácido-base que permiten la descomposición de los alimentos.
La autoprotólisis del agua es un concepto fundamental en química que explica por qué el agua puede comportarse como ácido y base, y es la base de la escala de pH que utilizamos para medir la acidez o basicidad de una solución.
El pH del agua: ¿Cómo puede ser ácido y base al mismo tiempo?
El pH del agua: ¿Cómo puede ser ácido y base al mismo tiempo?
El pH del agua es una medida que indica la acidez o alcalinidad de una sustancia. En el caso del agua, su pH neutro es 7. Sin embargo, el agua puede comportarse tanto como un ácido como una base, lo que puede resultar sorprendente para muchas personas.
Cuando el agua actúa como un ácido, libera iones de hidrógeno (H+), lo que disminuye el pH y lo hace más ácido. Por otro lado, cuando el agua se comporta como una base, acepta iones de hidrógeno, lo que eleva el pH y lo vuelve más alcalino.
Este fenómeno se debe a la capacidad del agua de actuar como un amortiguador o buffer, lo que le permite resistir cambios bruscos en su pH cuando se le añaden ácidos o bases. Los amortiguadores son fundamentales para mantener el equilibrio ácido-base en sistemas biológicos como la sangre humana, donde variaciones drásticas en el pH pueden resultar peligrosas.
Un ejemplo común de esta capacidad del agua para ser ácido y base al mismo tiempo se puede observar en la lluvia ácida. La lluvia ácida se forma cuando el agua de la atmósfera se combina con óxidos de azufre y nitrógeno, creando ácido sulfúrico y ácido nítrico. En este caso, el agua actúa como un ácido al reaccionar con estos compuestos, disminuyendo su pH y volviéndose más ácida.
Por otro lado, en ambientes naturales como lagos y océanos, el agua puede actuar como una base al reaccionar con minerales alcalinos disueltos, elevando su pH y volviéndose más alcalina. Este equilibrio dinámico entre la acidez y la alcalinidad del agua es esencial para mantener la vida acuática y los ecosistemas en equilibrio.
Implicaciones prácticas y experimentales de la dualidad ácido-base del agua
Las implicaciones prácticas de la dualidad ácido-base del agua son fundamentales en diversos campos de la química y la biología. Comprender que el agua puede comportarse como ácido o como base es esencial para explicar una amplia gama de fenómenos químicos y biológicos. A continuación, se detallan algunas de las aplicaciones más relevantes de esta dualidad:
1. Regulación del pH en sistemas biológicos
En los organismos vivos, el mantenimiento de un pH adecuado es crucial para el funcionamiento óptimo de procesos bioquímicos. El agua actúa como un amortiguador que ayuda a mantener el pH constante, permitiendo que las reacciones químicas se lleven a cabo de manera eficiente. Por ejemplo, en el cuerpo humano, el sistema de amortiguación ácido-base del agua es esencial para regular el pH sanguíneo y garantizar que las enzimas y proteínas funcionen correctamente.
2. Reacciones ácido-base en la industria química
En la industria, el agua como ácido o base es fundamental en diversas reacciones químicas. Por ejemplo, en la fabricación de productos químicos, la neutralización de ácidos y bases con agua es un proceso común. Además, en la síntesis de compuestos orgánicos, el agua puede actuar como catalizador en reacciones ácido-base, facilitando la formación de enlaces químicos.
3. Electroquímica y generación de energía
En el campo de la electroquímica, la dualidad ácido-base del agua es crucial para la generación de energía en pilas y baterías. Por ejemplo, en una pila de combustible, el agua participa en reacciones ácido-base que generan electricidad a partir de la energía química de un combustible. Comprender cómo el agua puede comportarse como ácido o base es esencial para optimizar la eficiencia de estos dispositivos.
La capacidad del agua para comportarse como ácido o como base tiene implicaciones significativas en diversos campos científicos y tecnológicos. Desde la regulación del pH en sistemas biológicos hasta la generación de energía en pilas de combustible, esta dualidad es fundamental para entender y aprovechar las propiedades únicas del agua en diferentes contextos.
Preguntas frecuentes
¿Por qué el agua puede comportarse como ácido o como base?
El agua puede comportarse como ácido al donar un protón (H+) o como base al aceptar un protón, dependiendo del medio en el que se encuentre.
¿Qué determina si el agua se comporta como ácido o como base?
El comportamiento del agua como ácido o base está determinado por la concentración de iones H+ y OH- presentes en la solución.
¿Qué es el equilibrio ácido-base del agua?
El equilibrio ácido-base del agua se refiere a la constante de equilibrio que existe entre la formación de iones H+ (iones hidrógeno) y OH- (iones hidroxilo) en el agua.
¿Cuál es el valor del pH del agua pura a 25°C?
El valor del pH del agua pura a 25°C es de 7, lo cual indica que se encuentra en un estado neutro.
¿Qué es la autoionización del agua?
La autoionización del agua es el proceso mediante el cual dos moléculas de agua reaccionan entre sí para formar iones hidrógeno (H+) e iones hidroxilo (OH-).
¿Cómo se mide la acidez o basicidad del agua?
La acidez o basicidad del agua se mide a través del pH, que es una escala que va de 0 a 14, donde valores menores a 7 indican acidez, 7 es neutro y valores mayores a 7 indican basicidad.
- El agua puede comportarse como ácido o base dependiendo del medio en el que se encuentre.
- El equilibrio ácido-base del agua está determinado por la concentración de iones H+ y OH-.
- El pH del agua pura a 25°C es de 7, indicando un estado neutro.
- La autoionización del agua es el proceso mediante el cual se forman iones H+ y OH-.
- La acidez o basicidad del agua se mide a través del pH, donde valores menores a 7 indican acidez y valores mayores a 7 indican basicidad.
¡Déjanos tus comentarios y revisa otros artículos relacionados con la química y el equilibrio ácido-base en nuestra web!