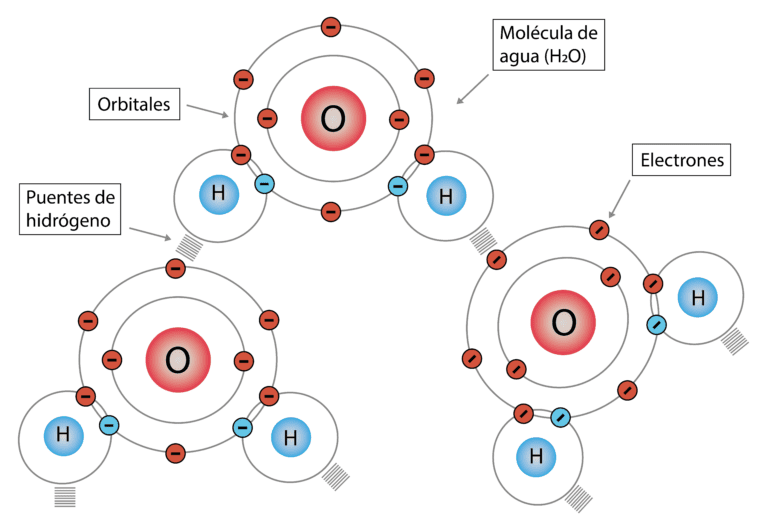
✅ La estructura del agua es tetraédrica en sólido (hielo), flexible en líquido y dispersa en vapor, adaptándose a cada estado con propiedades únicas.
La estructura tridimensional del agua cambia significativamente entre sus tres estados: sólido, líquido y gaseoso. En estado sólido, como el hielo, las moléculas de agua forman una estructura cristalina regular que es menos densa que el agua líquida, lo que explica por qué el hielo flota. En estado líquido, las moléculas de agua están más desordenadas y se mueven libremente, aunque aún mantienen una red de enlaces de hidrógeno. En el estado gaseoso, las moléculas de agua se encuentran muy separadas y se mueven de manera independiente con alta energía cinética.
Para entender mejor estos cambios, es fundamental analizar cómo se disponen las moléculas de agua en cada estado y cómo los enlaces de hidrógeno influyen en estas disposiciones. Este análisis no solo es importante para la química y la física, sino también para campos como la biología y la meteorología. A continuación, se detalla la estructura tridimensional del agua en sus tres estados:
Estado Sólido: Estructura del Hielo
En el estado sólido, el agua se organiza en una estructura hexagonal denominada hielo Ih. Cada molécula de agua se une a otras cuatro mediante enlaces de hidrógeno, formando un patrón tetraédrico. Esta disposición crea un entramado de cavidades que resulta en una menor densidad comparada con el agua líquida.
- Enlaces de Hidrógeno: Cada molécula de agua está unida a otras cuatro mediante enlaces de hidrógeno.
- Densidad: 0.917 g/cm³, lo que hace que el hielo flote en agua líquida.
- Configuración: Estructura cristalina hexagonal.
Estado Líquido: Agua
En el estado líquido, las moléculas de agua están en constante movimiento y no tienen una estructura fija. Sin embargo, los enlaces de hidrógeno aún juegan un papel crucial, formando y rompiéndose continuamente. Esta dinámica proporciona al agua sus propiedades únicas, como su alta capacidad calorífica y su capacidad para disolver muchas sustancias.
- Enlaces de Hidrógeno: Temporales y en constante cambio, cada molécula de agua forma, en promedio, 3.4 enlaces de hidrógeno.
- Densidad: 1 g/cm³ a 4°C, que es máxima a esta temperatura.
- Configuración: Estructura desordenada pero con tendencia a formar redes de enlaces de hidrógeno.
Estado Gaseoso: Vapor de Agua
En el estado gaseoso, las moléculas de agua están muy separadas y se mueven rápidamente debido a la alta energía cinética. En este estado, los enlaces de hidrógeno son prácticamente inexistentes, lo que permite que las moléculas se comporten de manera independiente.
- Enlaces de Hidrógeno: Prácticamente inexistentes.
- Densidad: Aproximadamente 0.0006 g/cm³ (variable con la temperatura y presión).
- Configuración: Moléculas independientes y en movimiento constante.
Comparación de la Estructura Tridimensional del Agua en sus Tres Estados
| Propiedad | Sólido (Hielo) | Líquido (Agua) | Gaseoso (Vapor) |
|---|---|---|---|
| Estructura | Hexagonal | Desordenada | Independiente |
| Densidad | 0.917 g/cm³ | 1 g/cm³ | 0.0006 g/cm³ |
| Enlaces de Hidrógeno | Fijos y estables | Temporales | Inexistentes |
Estado sólido del agua: estructura de los cristales de hielo
El estado sólido del agua, más conocido como hielo, presenta una estructura cristalina única que le confiere propiedades físicas distintivas. En esta fase, las moléculas de agua se organizan en una disposición regular y repetitiva, formando un patrón de red hexagonal. Esta configuración es crucial para entender las características del hielo.
Características de la estructura cristalina
En el hielo, cada molécula de agua está rodeada por otras cuatro moléculas, formando un tetraedro. Este arreglo espacial se debe a los enlaces de hidrógeno, que son más fuertes a bajas temperaturas. La estructura hexagonal del hielo es la más comúnmente observada y se denomina hielo Ih.
- El hielo Ih es la forma de hielo más abundante en la Tierra.
- La densidad del hielo Ih es aproximadamente 0.92 g/cm³, lo que es menor que la del agua líquida, permitiendo que el hielo flote.
- Existen otras formas de hielo, como el hielo II, hielo III, y hielo IV, que se forman bajo diferentes condiciones de presión y temperatura.
Casos de uso y aplicaciones
La comprensión de la estructura del hielo tiene aplicaciones prácticas en diversas áreas:
- Meteorología: El conocimiento de la formación y estructura del hielo es esencial para predecir el clima y entender fenómenos como la nieve y el granizo.
- Ingeniería: En la construcción de carreteras y aeropuertos, es crucial considerar la expansión del hielo para evitar daños estructurales.
- Medicina: La criopreservación utiliza el hielo para conservar células y tejidos, preservando su viabilidad durante largos períodos.
Datos interesantes y estadísticas
| Tipo de hielo | Condiciones de formación | Propiedades |
|---|---|---|
| Hielo Ih | Temperaturas menores a 0°C y presión atmosférica | Forma hexagonal, baja densidad |
| Hielo II | Presión elevada (3,000-4,000 atm) | Mayor densidad que el hielo Ih |
| Hielo III | Temperaturas muy bajas y presión elevada | Forma cúbica, extremadamente denso |
El hielo no es simplemente agua congelada; su estructura cristalina y las propiedades resultantes tienen un impacto significativo en múltiples disciplinas. La diversidad de formas de hielo y sus aplicaciones demuestran la complejidad y la importancia del estado sólido del agua.
Estado gaseoso del agua: comportamiento de las moléculas de vapor
El estado gaseoso del agua, también conocido como vapor de agua, es una fase en la que las moléculas de agua se encuentran muy separadas entre sí y en constante movimiento. Este comportamiento se debe a la alta energía cinética que poseen las moléculas en este estado, permitiéndoles desplazarse libremente y ocupar un volumen mayor.
Propiedades del vapor de agua
El vapor de agua tiene varias propiedades distintivas que lo diferencian de sus otros dos estados:
- Densidad baja: Las moléculas están muy dispersas, lo que resulta en una densidad significativamente menor en comparación con los estados líquido y sólido.
- Alta energía cinética: Las moléculas de vapor se mueven rápidamente, lo que contribuye a su capacidad de expansión y difusión.
- Compresibilidad: El vapor de agua es fácilmente compresible debido a la gran separación entre sus moléculas.
Ejemplos concretos y casos de uso
El vapor de agua se utiliza en una amplia variedad de aplicaciones en la vida cotidiana y en la industria. Algunos ejemplos incluyen:
- Generación de energía: Las plantas de energía térmica utilizan el vapor de agua para mover las turbinas y generar electricidad.
- Calefacción y refrigeración: En sistemas de calefacción central y aire acondicionado, el vapor de agua juega un papel crucial en la transferencia de calor.
- Procesos industriales: Muchas industrias, como la alimentaria y la farmacéutica, utilizan vapor de agua en procesos de esterilización y limpieza.
Comportamiento molecular y termodinámica
Desde una perspectiva termodinámica, el comportamiento del vapor de agua es fascinante. A medida que se calienta, las moléculas de agua ganan energía cinética y se mueven más rápidamente. Esto permite que las moléculas escapen de las fuerzas intermoleculares que las mantienen unidas en el estado líquido, transformándose en vapor.
Tabla comparativa de propiedades
| Propiedad | Estado Líquido | Estado Gaseoso (Vapor) |
|---|---|---|
| Densidad | Alta | Baja |
| Energía Cinética | Media | Alta |
| Compresibilidad | Baja | Alta |
Recomendaciones prácticas
Entender el comportamiento del vapor de agua puede ser útil en diversas situaciones prácticas. Por ejemplo, cuando trabajas con vapores en el hogar o en la industria, es importante tener en cuenta su alta energía y capacidad de expansión para evitar accidentes. Siempre utiliza equipos de protección adecuados y sigue las instrucciones de seguridad.
El estado gaseoso del agua, o vapor, es una fase de alta energía y baja densidad con aplicaciones prácticas importantes en la generación de energía, procesos industriales y sistemas de calefacción y refrigeración. Comprender sus propiedades y comportamientos es clave para su uso seguro y eficiente.
Preguntas frecuentes
¿Cuál es la estructura tridimensional del agua en estado sólido?
En estado sólido, las moléculas de agua se organizan en una red cristalina hexagonal con puentes de hidrógeno entre ellas.
¿Cómo es la estructura tridimensional del agua en estado líquido?
En estado líquido, las moléculas de agua se mueven de forma desordenada pero manteniendo los puentes de hidrógeno entre ellas.
¿Y en estado gaseoso, cuál es la estructura del agua?
En estado gaseoso, las moléculas de agua se encuentran muy separadas y en constante movimiento, sin formar puentes de hidrógeno significativos.
¿Por qué el agua es un compuesto único en cuanto a su estructura tridimensional?
El agua es única debido a la forma en que las moléculas de H2O pueden formar puentes de hidrógeno, lo que le confiere propiedades especiales como la alta cohesión y adhesión.
¿Cómo influye la estructura tridimensional del agua en sus propiedades físicas y químicas?
La estructura tridimensional del agua influye en su densidad, capacidad calorífica, tensión superficial, entre otras propiedades, lo que la hace un solvente universal y vital para los seres vivos.
| Estado del agua | Estructura Tridimensional |
|---|---|
| Sólido | Red cristalina hexagonal con puentes de hidrógeno |
| Líquido | Desordenada pero con puentes de hidrógeno |
| Gaseoso | Moléculas separadas y en movimiento |
¡Déjanos tus comentarios y visita nuestros otros artículos sobre química y propiedades del agua!